CATETER UMBILICAL (onfaloclisis)
Los vasos umbilicales son la vía de elección
para el neonato crítico. La canalización de los catéteres umbilicales es
realizada por el facultativo con más o menos ayuda del personal de enfermería según el hospital.
Contraindicaciones
- evidencia de compromiso vascular local en miembros inferiores o área umbilical.
- peritonitis.
- enterocolitis necrotizante (NEC).
- onfalitis.
- onfalocele.
Indicaciones
- Arterial, cuando se requieren determinaciones gasométricas frecuentes y para la monitorización continua
de la presión arterial (PA).
- Venoso, para la monitorización de la presión venosa
central (PVC), acceso inmediato para líquidos intravenosos y fármacos de emergencia,
exanguinotransfusión, acceso venoso de largo plazo en RNP de peso
extremadamente bajo y en espera de la canalización de un catéter
venoso epicutáneo. Contraindicaciones
- evidencia de compromiso vascular local en miembros inferiores o área umbilical.
- peritonitis.
- enterocolitis necrotizante (NEC).
- onfalitis.
- onfalocele.
Complicaciones
- Mecánicas (canalización dificultosa, mala posición del catéter, desplazamiento del mismo).
- Vasoespasmo (aplicar calor en el mismo miembro afectado).
- Hemorragia.
- Vasoespasmo (aplicar calor en el mismo miembro afectado).
- Hemorragia.
- Infección.
- Embolia o trombosis renal o aórtica.
- Isquemia: mesentérica, medular espinal o de
extremidades (aplicar calor en el miembro contrario al afectado).
- Arritmias cardiacas.
- Hipertensión portal.
- Enterocolitis necrotizante.
- Perforación intestinal.
- Embolia aérea.
Enfermería debe conocer y colaborar en la técnica de la canalización así como proporcionar los cuidados necesarios para un buen mantenimiento y su posterior retirada. Los vasos umbilicales pueden cateterizarse hasta la primera semana de vida, preferiblemente dentro de las primeras 72h antes de que empiecen a ligamentarse. Hay una vena y dos arterias (a veces solo una).
Material
* Material para mantener la asepsia: gorro,
mascarilla, bata estéril, guantes estériles, tallas estériles, gasas estériles y esponja con antiséptico (clorhexidina).
- 1 Pinza Iris
- 2 Pinzas de Adson sin dientes
- 2 Mosquitos curvos
- 1 Porta-aguja
- 1 Tijeras
- 1 Bisturí
- Seda 3/0 o 2/0 con aguja curva y triangular
- arterial: 2,5F para neonatos que pesan
menos de 1200grs y 3,5 para neonatos que pesan más de 1200grs.
· No se administrará por el catéter arterial
hemoderivados, ni drogas vasoactivas.
- venoso: 5F para neonatos que
pesan menos de 3500grs y 8F para
neonatos que pesan más de 3500grs. De una, dos o tres luces.
· Luz
distal (terminal): perfusión de base, NPT, calcio, hemoderivados y
medicación. PVC y extracciones de analíticas.
· Luz
proximal: drogas en infusión
continua si son necesarias, no
administrar simultáneamente por esta luz bolos de medicación.
* Cinta umbilical o seda del 0.
* Esparadrapo de tela, tiras de papel o adhesivo hidrocoloide extrafino.
* Jeringuillas de 5-2 y 1cc.
* Ampollas de 10cc de suero fisiológico.
* Mesa auxiliar.
* Antiséptico (clohexidina acuosa al 2%)
Pauta para su inserción
- Preparación y valoración del neonato, evitar
hipotermia, en la incubadora se manipulará por las ventanillas. Posición en
decúbito supino y monitorizar.
- Medir la distancia hombro-ombligo para calcular según tablas la longitud que habrá que introducir del catéter. Sumar la longitud del muñón umbilical a la longitud del
catéter. La longitud de inserción del catéter arterial es a 1/3 de la distancia hombro-ombligo si la inserción es baja o 2/3 si la inserción es alta. La longitud de inserción del catétervenoso se calcula a 2/3 de la distancia hombro-ombligo o la distancia del ombligo al apéndice xifoides x 0´6.
- Se utilizará una técnica aséptica. Higiene de manos quirúrgica y colocación de EPIs.
- Se dispondrá en una mesa auxiliar del material anteriormente descrito. Se tendrán preparadas las soluciones a perfundir (normalmente glucosadas).
- Colocar el campo estéril alrededor del
ombligo, dejando expuestos los pies y la cabeza.
- Anudar un fragmento de cinta umbilical alrededor
de la base del cordón, lo bastante ajustada como para minimizar la pérdida de
sangre pero lo suficientemente floja como para poder introducir con facilidad
el catéter a través del vaso.
- Cortar el exceso de cordón umbilical con tijeras
o bisturí, dejar un muñón de 1cm como mínimo.
- Mantener el cordón umbilical estable con el mosquito curvo o la pinza de Adson.
- Emplear la pinza Iris o la pinza de Adson sin
dientes para abrir y dilatar la arteria umbilical. Primero se coloca una rama
de la pinza y después se usan ambas ramas para dilatarla con suavidad.
- Una vez que la arteria / vena esté lo
suficientemente dilatada, introducir el catéter hasta la longitud apropiada. El
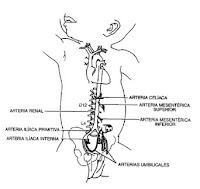
catéter arterial se coloca de dos maneras. En el llamado “cateterismo bajo” la
punta del catéter se localiza por debajo del nivel de L3 o L4. En el
“cateterismo alto” la punta se localiza por arriba del diafragma en el nivel de
D6 a D9 (tiene menos complicaciones). La posición suele ser determinada por cada hospital. La posición correcta para el catéter venoso es con la punta
del catéter a 0,5-1cm por arriba del
diafragma.
- Comprobar la permeabilidad del vaso
extrayendo un poco de sangre. Se extrae la suficiente
para hacer determinaciones analíticas.
- Conectar el catéter al equipo de perfusión y regular el ritmo de perfusión.
- Fijar con esparadrapo (en forma de puente), seda, hidrocoloide extrafino...
- Realizar una radiografía de tórax y
abdomen para verificar las posiciones de los catéteres arterial y venoso.
- Anotar en la gráfica: tipo
de catéter, centímetros introducidos y fecha.
Cuidados
de enfermería para un correcto mantenimiento
· Colocar al RN de forma que la zona de inserción
del catéter siempre visible (evitar el decúbito prono y tapar con el pañal)
· Vigilar la coloración de las
extremidades inferiores para detectar precozmente la aparición del posible
vasoespasmo producido por el catéter arterial. Si esto sucede se procederá a
envolver la extremidad contraria con compresas templadas, si no se observa
mejoría retirar el catéter.
· Evitar la entrada de aire en el catéter
umbilical por el riesgo de embolia gaseosa.
· Retirar y no recolocar el catéter
umbilical en caso de aparecer signos de insuficiencia vascular o trombosis.
· Cambiar los catéteres venosos umbilicales solo
en caso de mal funcionamiento.
· No utilizar cremas antimicrobianas en el sitio
de inserción del catéter ya que puede favorecer las infecciones fúngicas y la
resistencia antimicrobiana.
· No sumergir el catéter.
· Rigurosa asepsia a la hora de manipular el catéter (para curas, medicación, extracciones,etc.), siempre son necesarias dos personas: una estará estéril para realizar el procedimiento y la otra limpia para dar el material y recoger las muestras.
· Las
extracciones de sangre, administración de fármacos, o soluciones de lavado,
deben realizarse lentamente para evitar oscilaciones de la tensión arterial y
del flujo sanguíneo cerebral.
· Revisar la correcta fijación y localización
del catéter por turno, así como asegurar todas las conexiones y pinzar o cerrar
la luz del catéter en las desconexiones. Poner
«banderita» de esparadrapo próxima a la base del cordón umbilical, bien pegado
al catéter. Sujetar
el catéter con un esparadrapo con forma de puente a la piel. Al estar estos
sistemas en el exterior del paciente no es necesario que dichas sujeciones sean
estériles. No cubrir el cordón umbilical con ningún apósito.
· Curar la base del ombligo en cada turno con clorhexidina acuosa al 2%, medidas antiálgicas no medicamentosas previas. Limpiar el sitio de inserción con movimientos
circulares del centro a la periferia y deje secar durante 1 minuto.
· Controlar signos de infección como hiperemia en
la piel y supuración.
· Si
sangra la vena, colocar cordonete suave en la base del cordón, o cierre en
bolsa de tabaco.
Retirada de catéter umbilical
- Es decisión facultativa, el momento suele ser cuando ya no es
necesaria su utilidad o cuando se sospeche que hay complicaciones. Retirar el acceso
vascular tan pronto como el paciente no lo necesite, previa canalización de catéter epicutáneo central de acceso periférico (sylastic). En grandes prematuros se
mantendrá hasta 7-14 días para facilitar la mínima manipulación.
- Se cultiva la punta del catéter como control de posibles infecciones.
- Material:
· Guantes estériles.
· Gasas estériles.
· Clorhexidina acuosa al 2%.
· Tijeras o Bisturí estéril.
· Apósito hemostático.
· Bote para cultivo del catéter.
- Pauta:
· Rigurosa asepsia.
· Detener la infusión de los fluidos que están
siendo infundidos y clampar catéter.
· Colocar al neonato teniendo en cuenta medidas de
confort: rodillo, chupete, sacarosa.
· Poner un cordonete alrededor del cordón para clampar el cordón
en caso de sangrado que no cesa con presión en la zona de inserción.
· Desinfectar el muñón, con clorhexidina
acuosa al 2%.
· Retirar la fijación del catéter umbilical a la
piel del paciente.
· Retirar el catéter, si es venoso lentamente
para evitar sangrado, si es arterial hacer refluir un poco de
sangre y así poder ver el movimiento pulsátil de la arteria, se retira hasta
que queden 3 cm o pare el movimiento pulsátil, una vez detenido el movimiento
esperar unos minutos antes de terminar su retirada.
· Comprobar que el catéter está íntegro.
· Introducir el extremo del catéter, sin que
toque ninguna superficie, en un bote para cultivo de la punta del
catéter (entre 3 y 5cm).
· Cortar el catéter con tijeras estériles o con
el bisturí en su defecto, apoyando el bisturí en el bote para evitar sufrir un
corte accidental.
· Cursar la petición de cultivo junto con la muestra
al servicio de microbiología.
· Presionar con una gasa seca estéril el punto
de inserción durante 5 minutos, desinfectar la zona con una gasa impregnada en clorhexidina acuosa al
2% y colocar gasas estériles en la zona
umbilical. En algunos
casos es necesario dar un punto a la vía.
· Mantener la zona umbilical visible las horas siguientes a la
extracción del catéter para poder detectar sangrado. No colocar pañal sobre la
zona umbilical ni colocar al neonato en posición de decúbito prono.